Peptidi su klasa spojeva formiranih vezama od više aminokiselina kroz peptidne obveznice. Oni su sveprisutni u živim organizmima. Do sada su natečene desetine hiljada peptida u živim organizmima. Peptidi igraju važnu ulogu u regulaciji funkcionalnih aktivnosti različitih sistema, organa, tkiva i ćelija i u životnim aktivnostima, te se često koriste u funkcionalnoj analizi, istraživanju antitijela, razvoju lijekova i drugim poljima. Uz razvoj biotehnološke i peptidne tehnologije sinteze, sve više i više peptidnih lijekova razvijeno je i primjenjuje se u klinici.
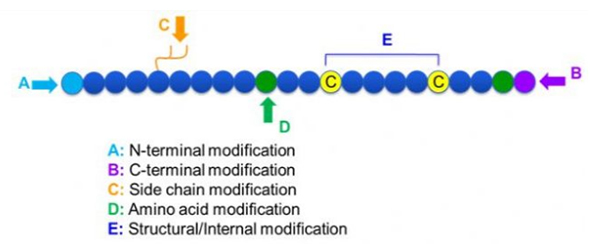
Postoji širok izbor modifikacija peptida, što se može jednostavno podijeliti u modifikaciju i promenu (koristeći izvedenu modifikaciju aminokiseline) i modifikaciju N-terminala, modifikacija C-terminala, modifikacija bočnog lanca, modifikacija aminone kiseline, itd., Ovisno o mestu za kostur (slika 1). Kao važno sredstvo za promjenu glavne lančane strukture ili bočne lance peptidnih lanaca, modifikacija peptida može učvrstiti mjehurita za rad u vivo-u, ukloniti imunogeničnost, uvesti imunogeničnost, itd. U ovom radu uvode nekoliko glavnih strategija peptidnih modifikacija i njihove karakteristike.
1. Biciklizacija
Ciklički peptidi imaju mnogo aplikacija u biomedicini, a mnogi prirodni peptidi s biološkom aktivnošću su ciklički peptidi. Budući da ciklički peptidi imaju čvrste od linearnih peptida, izuzetno su otporni na probavni sustav, mogu preživjeti u probavnom traktu i izložiti jači afinitet za ciljne receptore. Biciklizacija je najednostavniji način za sinteza cikličke peptide, posebno za peptide s velikim konstrukcijskim kosturom. Prema režimu ciklizacije, može se podijeliti u bočni lanac, tip, terminal - bočni vrstu lanca, terminal - tip terminala (kraj krajnjeg tipa).
(1) sidechain-to-sidechain
Najčešći tip bočnog lanca na biciklizmu bočnog lanca je disulfidna premošćavanje između ostataka cisteina. Ova biciklizacija uvodi se par ostataka cisteina koji se deprotiraju, a zatim oksidira za formiranje disulfidnih obveznica. Policiklička sinteza može se postići selektivnim uklanjanjem sulfhydryl zaštitnih grupa. Biciklizacija se može obaviti ili u ratovenu post disocijaciji ili na predispozicijskoj smoli. Biciklizacija na smolama može biti manje efikasna od ciklizacije otapala, jer peptidi na smolama ne čine lako za ciklicne sukladnosti. Druga vrsta ciklizacije bočnog lanca - stvaranje amidne konstrukcije između aspartičke ostatke kiseline ili glutamičke kiseline i bazne aminokiseline, za koje zahtijeva da se bočna lanac za zaštitu moći bile selekcije uklonjena iz smole ili nakon disocijacije. Treća vrsta bočnog lanca - ciklizacija bočne lanca je formiranje difenilnih etera od tirozina ili p-hidroksifenilglikona. Ova vrsta ciklizacije u prirodnim proizvodima nalazi se samo u mikrobnim proizvodima, a proizvodi protiv biciklizacija često imaju potencijalnu ljekovitu vrijednost. Priprema ovih spojeva zahtijeva jedinstvene uvjete reakcije, tako da se često ne koriste u sintezi konvencionalnih peptida.

(2) terminal-to-sidechain
Cinklizacija lančanog lanca obično uključuje C-terminal sa aminovom grupom lizinskog ili ornitinskog bočnog lanca, ili N-terminala sa aspartičkim aparatom ili lakom glutamske kiseline. Ostala polipeptidna ciklizacija vrši se formiranjem eter obveznica između terminala C i Serine ili treonine bočnih lanaca.
(3) Terminal ili tip glave do repa
Lančani polipeptidi mogu se biciklirati u otapalu ili fiksiraju na smolu na biciklizmu bočnih lanaca. Niske koncentracije peptida trebaju se koristiti u centralizaciji otapala kako bi se izbjegla oligomerizacija peptida. Prinos polipeptida sintetičkog prstena za glavu i rep, ovisi o nizu lančanog polipeptida. Stoga, prije pripreme cikličkih peptida u velikoj mjeri, prvo bi se trebala stvoriti biblioteka mogućih lažnih peptida, a zatim biciklizacija za pronalaženje slijeda s najboljim rezultatima.
2 n-metilacija
N-metilacija se izvorno javlja u prirodnim peptidima i uvede se u sintezu peptida kako bi se spriječilo stvaranje vodikovih obveznica, čime se peptidi otporne na biorazgradnju i čišćenje. Sinteza peptida koristeći N-metilirane derivate aminokiselina je najvažnija metoda. Pored toga, može se koristiti i mitsunobu reakcija n- (2-nitrobenzen sulfonyl hlorida) polipeptidna-smola intermedijana sa metanolom. Ova metoda se koristi za pripremu cikličkih peptidnih biblioteka koje sadrže n-metilirane aminokiseline.
3. Fosforilacija
Fosforilacija je jedna od najčešćih post-translacijskih modifikacija u prirodi. U ljudskim ćelijama, više od 30% proteina je fosforilacija. Fosforilacija, posebno reverzibilna fosforilacija, igra važnu ulogu u kontroli mnogih ćelijskih procesa, poput transdukcije signala, izraz gena, ciklusa ćelijskog ciklusa i citoskeletnika i apoptoze.
Fosforilacija se može primijetiti na različitim ostacima aminokiselina, ali najčešća ciljeva fosforizacije su serinski, treonini i tirozinski ostaci. Fosfotirozin, fosfothtreonin, i fosfozerinski derivati mogu se uvesti u peptide tokom sinteze ili formirane nakon sinteze peptida. Selektivni fosforilacija može se postići korištenjem ostataka serizma, treonina i tirozina koji selektivno uklanjaju zaštitne grupe. Neki fosforilacioni reagensi mogu uvesti i grupe fosforne kiseline u polipeptid post modifikaciji. Posljednjih godina, fosforilacija lizina specifična za lokaciju postignuta je hemijski selektivnom reakcijom sa stajedinger-fosfita (slika 3).

4. Myristooylacija i palmitoylacija
Acilacija N-terminala sa masnim kiselinama omogućava peptide ili proteine da se vežu za stanične membrane. Myridamoolirani slijed na N-terminalu omogućava porodici SRC porodice proteinske kinaze i obrnuto transkriptaze GaQ proteine da bi se ciljali za vezanje do ćelijskih membrana. Miristička kiselina bila je povezana sa N-terminalom smole-polipeptida pomoću standardnih reakcija spojnica, a rezultirajući lipopeptid bi mogao biti disociran u standardnim uvjetima i pročišćenim RP-HPLC-om.
5. Glikozilacija
Glikopeptidi poput Vancomicina i Teikolanina važni su antibiotici za liječenje bakterijskih infekcija otpornih na lijekove, a drugi glikopeptidi često se koriste za poticanje imunološkog sustava. Pored toga, budući da su mnogo mikroznih antigena glikozilirano, od velikog je značaja za proučavanje glikopeptida za poboljšanje terapijskog učinka infekcije. S druge strane, utvrđeno je da proteini na ćelijskoj membrani tumorskih stanica pokazuju nenormalnu glikozilaciju, što glikopeptidi čine važnu ulogu u istraživanju odbrane raka i tumora imunološke odbrane. Glikopeptidi pripremaju FMOC / T-BU metoda. Glikozilirani ostaci, kao što su Threonin i Serin, često se unose u polipeptidi pentafluorofenol ester aktiviranim fmocs za zaštitu glikozilanih aminokiselina.
6. Isoprene
Izopentadienilacija se javlja na ostacima cisteina u bočnom lancu u blizini C-terminala. Proteinski izopren može poboljšati afinitet ćelije membrane i formirati interakciju proteina proteina. Izopentadisni proteini uključuju tirozin fosfatazu, mali GTAze, kochaperone molekule, nuklearnu lamina i središnje vezanje proteina. Isoprene polipeptidi mogu se pripremiti pomoću izoprena na smolama ili uvođenjem cisteinskih derivata.
7. Polietilen glikol (PEG) modifikacija
Modifikacija PEG može se koristiti za poboljšanje hidrolističke stabilnosti proteina, biološke i peptidne topljivosti. Uvođenje peg lanaca na peptide može poboljšati svoja farmakološka svojstva i također inhibirati hidrolizu peptida proteolitičkim enzimima. Peg peptidi prolaze kroz glomerularni kapilarni presjek lakše od običnih peptida, uvelike smanjujući bubrežni klirens. Zbog proširenog aktivnog poluživota peptida u vivo, normalan nivo liječenja može se održavati nižim dozama i manje čestim peptidnim drogama. Međutim, modifikacija PEG ima i negativne efekte. Velike količine PEG sprečavaju enzim iz degradiranja peptida i također smanjuje vezanje peptida na ciljni receptor. Ali sa niskim afinitetom peptida Peg obično se nadoknađuje njihovim dužim farmakokinetičkim poluživotom, a prisutni u tijelu duže, peptidi veće vjerojatnosti da se apsorbiraju u ciljane tkive. Stoga se specifikacije PEG polimera trebaju optimizirati za optimalne rezultate. S druge strane, peptidni peptici nakupljaju se u jetri zbog smanjenog bubrežnog odobrenja, što rezultira makromolekularnim sindromom. Therefore, PEG modifications need to be designed more carefully when peptides are used for drug testing.

Zajedničke modifikacije modifikacija modifikatora mogu se grubo sažeti na sljedeći način: Amino (-amine) -NH2, aminometil-ch2-nh2, hydroxy-oh, karboksil-choh, sulfhydryl (-thiol) -sh, malemid-mal-male, sukcinimid acetat -scm, sukcinimid propionat -spa, N-Hydroxysuccinimide -NHS, Akrilate-CH2CH2Cooh, Aldehid-a (kao što su propional-ald, butyyld), akrilna baza (Akrilna baza), azido-azid, biotinyl -biotin, fluorescein, glutaryl -ga, akrilatni hidrazid, alkyne-alkyne, P-toluensulfonate -ots, sukcinimid sukcine -ss, itd. PEG derivati s karboksilnim kiselinama mogu se spojiti na n-terminal a aMines ili lizinske bočne lance. Amino aktivirano PEG može se spojiti na aspartičke akrilne ili glutamske kiseline bočni lanci. Mal-aktivirano kline mogu se konjugirati za Merkaptan u potpunim ispravljenim cisteinskim bočnim lancima [11]. PEG modifikatori obično se klasificiraju na sljedeći način (Napomena: MPEG je metoksi-peg, CH3O- (Ch2ch2o) N-CH2CH2-OH):
(1) modifikator ravnog lanca
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-ALD, MPEG-BUTYRALD, MPEG-SS
(2) BifunctionIal PEG modifikator
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-COOH, MAL-PEG-NHS
(3) Modifikator za razgraničenje PEG
(MPEG) 2-NHS, (MPEG) 2-ald, (MPEG) 2-NH2, (MPEG) 2-mal
8. Biotionizacija
Biotin se može snažno vezati sa Avidin ili Streptavidin, a veza koja je obvezuju čak i blizu kovalentne veze. Peptidi označeni biotin obično se koriste u imunoasay, histokyhemistry i crnoresnoj citometriji tokom fluorescencije. Označena antibiotinska antitijela mogu se koristiti i za vezanje biotiniliranih peptida. Etikete biotina često su pričvršćene na lizin bočni lanac ili N terminal. 6-aminokaproična kiselina često se koristi kao veza između peptida i biotina. Veza je fleksibilna u vezivanju na podlogu i veže se bolje u prisustvu sterične prepreke.
9. Fluorescentno označavanje
Fluorescentno označavanje može se koristiti za praćenje polipeptida u živim ćelijama i studirati enzime i mehanizme djelovanja. Triptofan (TRP) je fluorescentni, pa se može koristiti za intrinzično označavanje. Emisijski spektar triptofan ovisi o perifernom okruženju i smanjuje se s smanjenjem rastvorljive polaritetom, nekretninom koja je korisna za otkrivanje veže za peptidnu strukturu i obvezujući receptor. Tryptophan fluorescencija može se ugasiti protoniranom aspartičkom kiselinom i glutamičkom kiselinom, što može ograničiti njegovu upotrebu. Grupa DansilL hlorida (Dansyl) vrlo je fluorescentna kada je vezana za amino grupu i često se koristi kao fluorescentna etiketa za aminokiseline ili proteine.
Fluorescencija Rezonanca za pretvorbu energije (FRET) korisna je za enzimske studije. Kada se primijeni Fret, polipeptid supstrata obično sadrži grupu za fluorescenciju i grupu za gašenje fluorescencije. Označene fluorescentne grupe udaraju ga u gašincu kroz ne-fotonorni prijenos energije. Kad se peptid ne distribuira iz dotičnog enzima, grupno označavanje emitira fluorescenciju.
10. Kavez polipeptidi
Peptidi kaveza imaju optički uklonjive zaštitne grupe koje štite peptid od vezivanja do receptora. Kada je izložena UV zračenju, peptid se aktivira, vraćajući svoj afinitet na receptor. Budući da se ova optička aktivacija može kontrolirati prema vremenu, amplitudi ili lokaciji, kavezni peptidi mogu se koristiti za proučavanje reakcija koje se događaju u stanicama. Najčešće korištene zaštitne grupe za kavez polipeptidi su dvo-nitrobenzilne grupe i njihovi derivati, koji se mogu uvesti u sintezu peptida putem zaštitnih derivata aminokiselina. Derivati aminokiselina koji su razvijeni su lizine, cisteine, serine i tirozin. Derivati aspartata i glutamatita, međutim, obično se ne koriste zbog njihove osjetljivosti na biciklizmu tokom sinteze peptida i disocijacije.
11. Poliantigenski peptid (karta)
Kratki peptidi obično nisu imuni i moraju se spojiti za nosače proteine za proizvodnju antitijela. Poliantigenski peptid (karta) sastoji se od više identičnih peptida povezanih sa lizinskim jezgrama, što može posebno izraziti imunogene visokog potencijala i može se koristiti za pripremu proteinskih kablova sa peptidnim nosačem. Karta Polipeptidi se mogu sintetizirati sintezom čvrste faze na smoli karte. Međutim, nepotpune spojnice rezultira nestalim ili skraćenim peptidnim lancima na nekim granama i tako ne pokazuje svojstva izvornog mapa polipeptida. Kao alternativa, peptidi se mogu pripremiti i pročistiti odvojeno, a zatim zajedno sastaviti za kartu. Peptidni slijed pričvršćen na jezgru peptida dobro je definiran i lako karakterizira masovna spektrometrija.
Zaključak
Modifikacija peptida važno je sredstvo za dizajn peptida. Hemijski modificirani peptidi ne mogu samo održavati visoku biološku aktivnost, već i efikasno izbjegavati nedostatke imunogenosti i toksičnosti. Istovremeno, hemijska modifikacija može obdati peptide s nekim novim izvrsnim svojstvima. Posljednjih godina metoda C-H aktivacije za post-modifikaciju polipeptida brzo se razvija, a postignuti su mnogi važni rezultati.
Vrijeme objavljivanja: 2025-07-03
