Fosforilacija utječe na sve aspekte ćelijskog života, a proteinske kinaze utječu na sve aspekte unutarćelijskih komunikacijskih funkcija reguliranjem signalnih staza i ćelijskih procesa. Međutim, aberantna fosforilacija je ujedno i uzrok mnogih bolesti; Konkretno, mutirane proteinske kinaze i fosfataze mogu uzrokovati mnoge bolesti, a mnogi prirodni toksini i patogeni također imaju učinak promjenom statusa fosforizacije unutarćelijskih proteina.
Fosforilacija Serin (SER), Threonine (THR) i tirozin (Tyr) je reverzibilni proces modifikacije proteina. Oni su uključeni u regulaciju mnogih mobilnih aktivnosti, kao što su signalizacija receptora, udruženja proteina i segmentacije, aktiviranje ili inhibicija proteinskih funkcija, pa čak i opstanak ćelija. Fosfati se negativno naplaćuju (dva negativna optužba po fosfatnu grupu). Stoga njihov dodatak mijenja svojstva proteina, što je obično konformacijske promjene, što dovodi do promjene u strukturi proteina. Kada se ukloni fosfatna grupa, konformacija proteina vratit će se u prvobitno stanje. Ako dva konformatalna proteina pokazuju različite aktivnosti, fosforilacija bi mogla djelovati kao molekularni prekidač za proteina za kontrolu njegove aktivnosti.
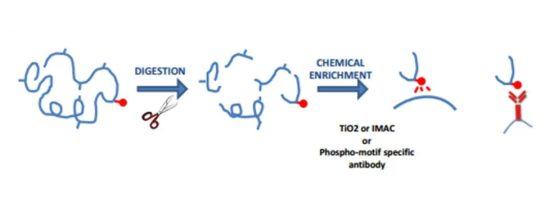
Mnogi hormoni regulišu aktivnost specifičnih enzima povećanjem stanja fosforizacije Serin (SER) ili Threonine (THR) ostaci, te tirozin (Tyr) fosforilacija mogu se pokrenuti faktorima rasta (kao što su inzulin). Fosfatne grupe ovih aminokiselina mogu se brzo ukloniti. Dakle, ser, Tvr i Tyr funkcionira kao molekularni prekidači u regulaciji staničnih aktivnosti kao što su proliferacija tumora.
Sintetički peptidi igraju vrlo korisnu ulogu u proučavanju proteinske kinaze supstrat i interakcija. Međutim, postoje neki faktori koji ometaju ili ograničavaju prilagodljivost tehnologije sinteze fosfopeptida, poput nemogućnosti postizanja pune automatizacije solidne fazne sinteze i nedostatka prikladne veze sa standardnim analitičkim platformama.
Tehnologija peptidne sinteze i fosforizacije platforme prevladava ta ograničenja, uz poboljšavajući efikasnost i skalabilnost sinteze, a platforma je pogodna za proučavanje supstrata proteinskih kinaza, antigena, veznih molekula i inhibitora.
Vrijeme objavljivanja: 2025-07-02
