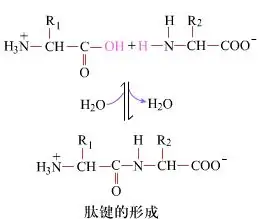
Na površini, formiranje peptidnih veza, koje daju dipeptide, je jednostavan hemijski proces.To znači da su dvije komponente aminokiselina povezane peptidnom vezom, amidnom vezom, dok su dehidrirane.
Stvaranje peptidne veze je aktivacija aminokiseline u uslovima blagih reakcija.(A) karboksilni dio, druga aminokiselina (B) Nukleofilno aktivirani karboksilni dio tada formira dipeptid (AB).“Ako karboksilna komponenta (A) nije zaštićena, formiranje peptidne veze ne može se kontrolirati.”Nusproizvodi kao što su linearni i ciklični peptidi mogu se miješati sa ciljnim jedinjenjima AB.Stoga, sve funkcionalne grupe koje nisu uključene u formiranje peptidne veze moraju biti zaštićene na privremeno reverzibilan način tokom sinteze peptida.
Dakle, sinteza peptida - formiranje svake peptidne veze - uključuje tri koraka agregacije.
Prvi korak je priprema nekih aminokiselina kojima je potrebna zaštita, a cwitterionska struktura aminokiselina više ne postoji.
Drugi korak je reakcija u dva koraka za formiranje peptidnih veza, u kojoj se karboksilna grupa N-zaštićene aminokiseline prvo aktivira na aktivni intermedijer, a zatim se formira peptidna veza.Ova spregnuta reakcija može se dogoditi ili kao reakcija u jednom koraku ili kao dvije uzastopne reakcije.
Treći korak je selektivno uklanjanje ili potpuno uklanjanje zaštitne podloge.Iako se svo uklanjanje može dogoditi tek nakon što su svi peptidni lanci sastavljeni, potrebno je i selektivno uklanjanje zaštitnih grupa kako bi se nastavila sinteza peptida.
Zato što 10 aminokiselina (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec i Cys) sadrže funkcionalne grupe bočnog lanca, koje zahtijevaju selektivnu zaštitu, čineći sintezu peptida složenijom.Moraju se razlikovati privremene i polutrajne zaštitne baze zbog različitih zahtjeva za selektivnost.Privremene zaštitne grupe se koriste u sljedećem koraku da odražavaju privremenu zaštitu aminokiselinskih ili karboksilnih funkcionalnih grupa.Polutrajne zaštitne grupe se uklanjaju bez ometanja već formiranih peptidnih veza ili bočnih lanaca aminokiselina, ponekad tokom sinteze.
„U idealnom slučaju, aktivacija karboksilne komponente i naknadno formiranje peptidnih veza (reakcije spajanja) treba da budu brze, bez formiranja racemskih ili nusproizvoda, a molarne reaktante treba primijeniti kako bi se postigli visoki prinosi.”Nažalost, nijedna od metoda kemijskog spajanja ne zadovoljava ove zahtjeve, a nekoliko je pogodnih za praktičnu sintezu.
Tokom sinteze peptida, funkcionalne grupe uključene u različite reakcije obično su povezane sa manuelnim centrom, glicin je jedini izuzetak i postoji potencijalni rizik od rotacije.
Poslednji korak u ciklusu sinteze peptida je uklanjanje svih zaštitnih grupa.Selektivno uklanjanje zaštitnih grupa je važno za produžavanje peptidnog lanca pored zahtjeva za potpunim uklanjanjem zaštite u sintezi dipeptida.Sintetičke strategije treba pažljivo planirati.U zavisnosti od strateškog izbora, N može selektivno ukloniti α-amino ili karboksilne zaštitne grupe.Termin "strategija" se odnosi na redosled reakcija kondenzacije pojedinačnih aminokiselina.Općenito, postoji razlika između postupne sinteze i kondenzacije fragmenata.Sinteza peptida (takođe poznata kao "konvencionalna sinteza") odvija se u rastvoru.U većini slučajeva, postepeno produžavanje peptidnog lanca može se sintetizirati samo korištenjem peptidnog lanca za sintezu kraćih fragmenata.Da bi se sintetizirali duži peptidi, ciljni molekuli se moraju segmentirati u odgovarajuće fragmente i utvrditi da mogu minimizirati stupanj diferencijacije na C kraju.Nakon što se pojedinačni fragmenti postepeno sastavljaju, ciljni spoj će biti spojen.Strategija sinteze peptida uključuje odabir najboljeg i najprikladnijeg zaštitnog fragmenta, a strategija sinteze peptida odabir najprikladnije kombinacije zaštitnih baza i najbolje metode konjugacije fragmenata.
Vrijeme objave: Jul-19-2023